
翌圣生物重要战略合作伙伴——博生吉医药集团自主研发的,基于Vδ1T细胞的靶向CD19的通用现货型嵌合抗原受体(CAR)-T细胞注射液(研发代号:UTAA09注射液)临床试验申请,获得国家药监局临床批件(药物临床试验批准通知书编号:2025LP01155),用于治疗成人复发/难治性急性B淋巴细胞白血病(B-ALL)。
全球首个获批临床试验的通用现货型CD19-UCAR-Vδ1T细胞产品
UTAA09注射液是博生吉申报的首个通用现货型的CAR-T细胞产品,该产品是以健康供者单采血为起始原材料制备而成的UCAR-Vδ1T细胞产品。据悉,这也是全球首个获批临床试验的通用现货型CD19-UCAR-Vδ1T细胞产品。
本次获得受理的UTAA09注射液,不仅保持了其强大的组织脏器归巢能力、而且在CMC制备工艺上,走在了全球前列,实现了细胞药物成本的极大改善,为UTAA09注射液未来将适应症拓展至自身免疫性疾病等适应症创造了条件。
翌圣生物护航研发,同筑创新坦途
翌圣生物为博生吉医药集团提供E.coli宿主细胞DNA残留检测试剂盒、HIV-1 p24 ELISA Kit等产品助力UTAA09快速获批IND。
翌圣生物自主研发的E.coli宿主细胞残留DNA的qPCR法检测试剂盒,可快速高效检测生物药中宿主DNA残留量。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。
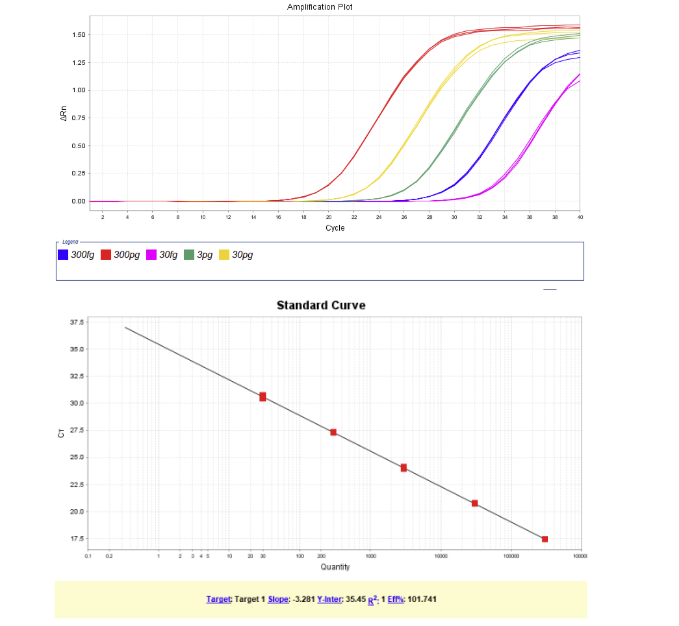
图. E.coli DNA (2G)标曲范围30fg/μL~300pg/μL,R2=1,扩增效率为101.74%,各浓度检测值CV<15%
翌圣生物制品质量安全产品解决方案
在生物制品领域,翌圣生物始终致力于为各类前沿生物制品,如基因治疗、细胞治疗、mRNA、抗体药、疫苗等,提供全方位的产品质量与安全解决方案。从精准检测产品相关杂质,到严格把控工艺相关杂质,再到严密防控生物风险,翌圣生物以专业、高效的技术与产品,全方位守护生物制品质量安全,助力产业稳健前行。
关于博生吉医药集团
博生吉医药集团是一家专注于CAR-T、CAR-γδT、in vivo CAR以及NKCE细胞产品等肿瘤细胞免疫治疗技术与产品的研发生产以及临床转化的国家高新技术企业,致力于开发具有国际领先水平的突破性First-in-class和Best-in-class CAR-T细胞药物。
公司现已建成近一万平方米符合GMP标准的商业化生产基地,是目前亚太区领先的全自动CAR-T细胞生产基地。基地内设有达到国际一流水平的质粒与慢病毒GMP生产与纯化车间、P2安全实验室、质控室与研发实验室,拥有完整的从质粒、慢病毒,一直到CAR-T细胞制备的全链条生产体系,具备源头创新、质量控制、商业化生产、冷链运输的全产业链布局,是我国目前少数建有最完备的全自动、全密闭CAR-T细胞生产线的企业。
